Physique – Chimie
TP : préparation des réactifs et tampons
1. RÉACTIFS ET ÉTALONS
L’eau utilisée pour la préparation des réactifs et des solutions étalons est de l’eau déminéralisée (ED).
À moins d’indication contraire, les solutions préparées peuvent se conserver indéfiniment à la température ambiante. Cependant, elles doivent être refaites s’il y a un changement de couleur à la solution ou s’il y a formation d’un précipité.
Une solution à 1 M signifie une concentration à 1 mol/L ou encore 1 mol.L-1
1. Préparation d’une solution d’acide sulfurique d’environ 0,5 M (pour l’alcalinité)
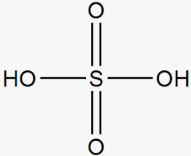
Utiliser une solution commerciale ou la préparer comme suit :
Lorsque l’acide sulfurique est destiné à être employé comme électrolyte pour batterie au plomb, l’acide est dilué à une concentration de 29 à 32 % (soit [H2SO4] ≈ 4,2 à 5 mol/l)
Diluer 100 ml de H2SO4 dans environ 800 ml d’eau, laisser refroidir et compléter à 1 000 ml avec de l’eau (ED). pH ≈ 0
2. Préparation d’une solution d’acide sulfurique d’environ 0,05 M (pour l’alcalinité)
Utiliser une solution commerciale ou la préparer comme suit :
Diluer 100 ml de H2SO4 d’environ 0,5 M dans environ 800 ml d’eau, laisser refroidir et compléter à 1 000 ml avec de l’eau (ED). Cette solution se conserve 6 mois à température ambiante. pH ≈ 1,3
3. Préparation d’une solution d’acide sulfurique d’environ 0,01 M (pour l’alcalinité)
Utiliser une solution commerciale ou la préparer comme suit :
Diluer 20 ml de la solution de H2SO4 d’environ 0,5 M dans environ 500 ml d’eau et compléter à 1000 ml avec de l’eau. Cette solution se conserve 6 mois à la température ambiante. pH ≈ 2,0
4. Préparation d’une solution de carbonate de sodium d’environ 0,04 M (pour l’alcalinité)
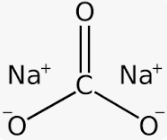
Peser précisément 4,2 g de Na2CO3 et dissoudre dans une fiole jaugée de 1000 ml contenant environ 500 ml d’eau (ED). Compléter au trait de jauge avec de l’eau (ED). Cette solution se conserve une semaine à la température ambiante. pH ≈ 1,4
5. Préparation d’une solution d’hydroxyde de sodium, 1,0 M (pour l’acidité)
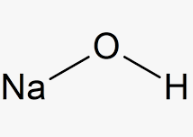
Utiliser une solution commerciale ou la préparer comme suit :
Peser précisément 40,0 g de pastilles de NaOH et dissoudre dans une fiole jaugée de 1000 ml contenant environ 500 ml d’eau (ED). Laisser refroidir et compléter au trait de jauge avec de l’eau. Cette solution se conserve une semaine à la température ambiante. pH ≈ 14,0
6. Préparation d’une solution d’hydroxyde de sodium, 0,20 M (pour l’acidité)
Utiliser une solution commerciale ou la préparer comme suit :
Diluer 200 ml de la solution de NaOH 1,0 M dans environ 500 ml d’eau (ED) et compléter à 1000 ml avec de l’eau (ED).
Cette solution se conserve une semaine à la température ambiante. pH ≈ 13,3
7. Préparation d’une solution d’hydroxyde de sodium, 0,02 M (pour l’acidité)
Utiliser une solution commerciale ou la préparer comme suit :
Diluer 20 ml de la solution de NaOH 1,0 M dans environ 500 ml d’eau (ED) et compléter à 1000 ml avec de l’eau (ED).
Cette solution se conserve une semaine à la température ambiante. pH ≈ 12,3
8. Solution de liqueur de Fehling
-solution A: 40g de sulfate de cuivre à compléter à 1L d’eau déminéralisée (ED)
– solution B: 200g se Sel de Seignette + 150g de NaOH à compléter à 1L en eau déminéralisée (ED)
mélanger les 2 solutions, volume à volume, la veille de l’utilisation.
9. Solution de réactif 2,4- DNPH
Dans un bain de glace : dissoudre 15g de 2,4-DNPH dans 75mL d’acide sulfurique (H2SO4) à 98%.
Ajouter 100mL d’eau déminéralisée (ED).
Ajouter 350mL d’éthanol.
10. Solution réactif de Biuret
– dissoudre 3g de sulfate de cuivre (CuSO4) + 9g de Tartatre de potassium et de sodium tétrahydraté (KNaC4H4O6·4H2O) = sel de seignette dans 500mL d’eau déminéralisée (ED)
– ajouter 8g d’hydroxyde de sodium (NaOH) et 5g de iodure de potassium (KI) puis compléter à 1L en eau déminéralisée (ED).
2. ÉTALONNAGES
2.1. ÉTALONNAGE DU pH-MÈTRE
− Enlevez ce capuchon qui protège l’électrode. Vérifier l’état de l’électrode. Rincer l’électrode avec de l’eau (ED). Ne pas essuyer l’électrode avant utilisation. L’électrode sera conservée pour stokage dans une solution de KCl à 3 ou 3,5 mol/L.
− L’étalonnage du pH-mètre s’effectue avec les solutions tampons à pH de 4, 7 et 10 chaque jour d’utilisation.
− Immergez le bout de l’électrode et agitez la solution pendant une trentaine de secondes avant lecture du pH.
2.2. Rappels
Si on dilue un acide alors son pH augmente : il devient moins acide.
Si on dilue une base alors son pH diminue : il devient moins basique.
Pour un acide fort : pH = – log C.
Pour une base forte: pH = 14 + log C.
