Physique – Chimie
Exercices d’application : Bilan de matière simple, Tableau d’avancement
Données : M(C) = 12 g.mol-1 ; M(H) = 1 g.mol-1 ; M(O) = 16 g.mol-1
Exercice n°1 : Tableaux d’avancement
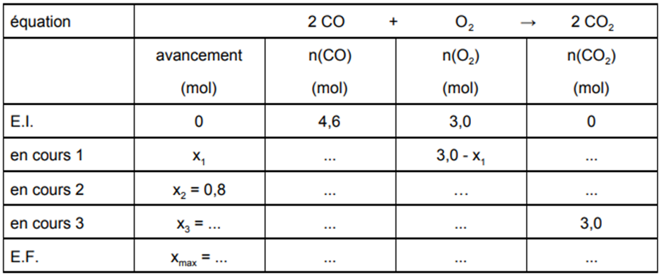
Compléter le tableau suivant, dans lequel (E.I.) signifie l’état initial, (E.F.) l’état final et « en cours » désigne l’état du système en cours d’évolution pour divers avancement.
Indiquer le réactif limitant.
ELEMENTS DE CORRECTION
état initial (E.I.) à t = 0 s pour lequel l’avancement est nul (x = 0), nous avons :
4,6 mol de monoxyde de carbone (CO) sont mis en contact avec 3,0 mol de dioxygène (O2). La réaction chimique n’ayant pas encore débuté, il y a 0 mol de dioxyde de carbone (CO2) de formée.
En cours 1 pour lequel l’avancement est x = x1 , nous avons :
4,6 – 2x1 mol de monoxyde de carbone (CO) réagissent avec 3,0 – 1x1 mol de dioxygène (O2). La réaction chimique a débuté, il y a 0 + 2x1 mol de dioxyde de carbone (CO2) formée
En cours 2 pour lequel l’avancement est x = x2 , avec x2 = 0,8 mol, nous avons :
4,6 – 2 × 0,8 mol = 3,0 mol de monoxyde de carbone (CO) réagissent avec 3,0 – 0,8 mol = 2,2 mol de dioxygène (O2). La réaction chimique se poursuit, il y a 0 + 2 × 0,8 mol = 1,6 mol de dioxyde de carbone (CO2) formée
En cours 3 pour lequel l’avancement est x = x3 , avec x3 = 1,5 mol, nous avons :
4,6 – 2×1,5 mol = 1,6 mol de monoxyde de carbone (CO) réagissent avec 3,0 – 1,5 mol = 1,5 mol de dioxygène (O2). La réaction chimique se poursuit, il y a 0 + 2 × 1,5 mol = 3,0 mol de dioxyde de carbone (CO2) formée
état final (E.F.) pour lequel l’avancement est x = xmax , avec xmax = 2,3 mol, nous avons :
La réaction chimique se termine. Il reste 4,6 – 2 × 2,3 mol = 0 mol de monoxyde de carbone (CO) et 3,0 – 2,3 = 0,7 mol de dioxygène (O2). Il s’est formé 0 + 2 × 2,3 mol = 4,6 mol de dioxyde de carbone (CO2).
Le dioxygène (O2) est un réactif en excès.
Exercice n°2 : Tableau d’avancement
- Compléter le remplissage du tableau suivant :
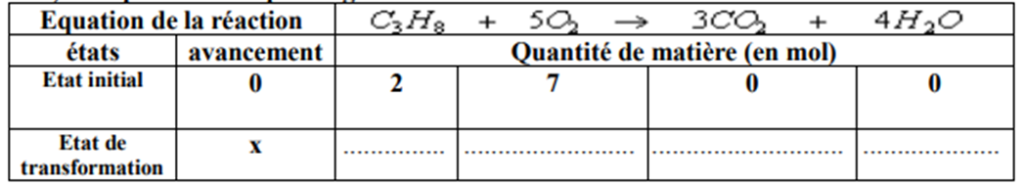
- Dans le cas où l’avancement x=1mol, déterminer les quantités de matière n(C3H8) et n(O2) restants.
- Dans le cas où l’avancement x=1mol, déterminer les quantités de matière n(C3H8) et n(O2) qui ont réagi.
- Déterminer le réactif limitant?
- La valeur de l’avancement x pourra –elle être supérieure à 1mol? Justifiez.
- Donner le bilan de la réaction.
ELEMENTS DE CORRECTION
état initial (E.I.) à t = 0 s pour lequel l’avancement est nul (x = 0), nous avons :
2,0 mol de propane (C3H8) sont mis en contact avec 7,0 mol de dioxygène (O2). La réaction chimique n’ayant pas encore débuté, il y a 0 mol de dioxyde de carbone (CO2) et 0 mol d’eau (H2O) de formées.
En cours pour lequel l’avancement est x > 0, nous avons :
2 – x mol de propane (C3H8) réagissent avec 7,0 – 5x mol de dioxygène (O2). La réaction chimique a débuté, il y a 0 + 3x mol de dioxyde de carbone (CO2) et 0 + 4x mol d’eau (H2O) de formées.
Si x = 1 mol alors :
Il reste 2 – 1 mol = 1 mol de propane (C3H8) et 7,0 – 5×1 mol = 2 mol de dioxygène (O2). La réaction chimique a permis de former 0 + 3×1 mol = 3 mol de dioxyde de carbone (CO2) et 0 + 4×1 mol = 4 mol d’eau (H2O).
Ou encore, 1 mol de propane (C3H8) a réagi avec 5 mol de dioxygène (O2).
Dans ce cas, si x = 1 mol, alors le propane (C3H8) est le réactif limitant.
x = 1,4 mol sera la quantité maximale pour que la réaction soit totale. x ne pourra pas prendre la valeur 2 mol car, dans ce cas, le réactif dioxygène (O2) sera limitant.
Exercice n°3 : Tableau d’avancement
L’éthanol, liquide incolore, de formule C2H6O brûle dans le dioxygène pur. Il se forme du dioxyde de carbone et de l’eau. On fait réagir m = 2,50 g d’éthanol et un volume V = 2,00 L de dioxygène.
1) Ecrire l’équation chimique modélisant la réaction.
2) Décrire l’état initial du système.
3) Calculer l’avancement maximal. Quel est le réactif limitant ?
4) Déterminer la composition, en quantité de matière, du système à l’état final. Déterminer les volumes de produits obtenus.
Donnée : volume molaire dans les conditions de l’expérience : 25,0 L.mol-1
ELEMENTS DE CORRECTION
Éthanol + Dioxygène => eau + dioxyde de carbone
C2H6O + 3 O2 → 3 CO2 + 2 H2O
état initial (E.I.) à t = 0 s pour lequel l’avancement est nul (x = 0), nous avons :
1,0 mol d’éthanol (C2H6O) mis en contact avec 3,0 mol de dioxygène (O2). La réaction chimique n’ayant pas encore débuté, il y a 0 mol de dioxyde de carbone (CO2) et 0 mol d’eau (H2O) de formées.
état final (E.F.) pour lequel l’avancement est x = xmax nous avons :
La réaction chimique se termine. Il reste n – 1xmax mol d’éthanol (C2H6O) et n- 3,0 xmax mol de dioxygène (O2). Il s’est formé 0 + 3 xmax mol de dioxyde de carbone (CO2) et 0 + 2 xmax mol d’eau (H2O).
Calcul du nombre de moles d’éthanol en réaction
méthanol = 2,50g
Méthanol = 2×12 + 6×1 + 1×16 = 46g.mol-1
n=m/M soit n = 2,50 / 46 soit n=0,054 mol d’éthanol
Calcul du nombre de moles de dioxygène en réaction
vO2=2,00 L
V=25,0 L.mol-1
n=v/V soit n = 2/25 soit 0,080 mol de dioxygène
Calcul de l’état d’avancement maximal par réactif
Pour l’éthanol : ni – xmax1 mol = 0 mol d’éthanol soit xmax1 = 0,054 mol d’éthanol
Pour le dioxygène : ni – 3xmax2 mol = 0 mol de dioxygène soit xmax2 = 0,080 / 3 soit =0,027 mol de dioxygène
Le xmax possible est 0,027 mol (valeur la plus petite). Le réactif limitant sera le dioxygène.
Calcul de la composition, en quantité de matière, du système à l’état final
état final (E.F.) pour lequel l’avancement est xmax = 0,027 mol nous avons :
La réaction chimique se termine. Il reste0,054 – 0,027 mol = 0,027 mol d’éthanol (C2H6O) et 0,080 – 3,0 × 0,027 = 0 mol de dioxygène (O2). Il s’est formé 0 + 3× 0,027 mol = 0,081 mol de dioxyde de carbone (CO2) et 0 + 2 × 0,027 = 0,054 mol d’eau (H2O).
Calcul des volumes des produits obtenus
Pour le dioxyde de carbone : n = m/M soit m= n × M
m (CO2) = 0,081 × [12+ 2 × 16] soit m (CO2) = 3,564 g
Pour l’eau : n = m/M soit m= n × M
m (H2O) = 0,054 × [2 × 1 + 16] soit m (H2O) = 0,972 g
