Mathématiques
Titre alcalimétrique (TA) et titre alcalimétrique complet (TAC)
1. Titre alcalimétrique (T.A.)
1.1. Calculer le TA
C’est le volume d’acide (exprimé en mL) à 0,02 mol.L – 1 en ions H3O+ nécessaire pour doser 100 mL d’eau en présence de phénolphtaléine.
Le T.A. s’exprime en degré français (°f). 1°f équivaut à 3,4 mg/L d’ion hydroxyde (HO–) ou à 6 mg/L d’ion carbonate (CO32-).
Le titre alcalimétrique (TA) d’une eau permet de connaître sa concentration en carbonates (CO32-) et en bases fortes, autrement dit son alcalinité.
Mesure du TA
Soit une eau contenant des ions hydroxyde, carbonate et hydrogénocarbonate.
Le dosage en présence de phénolphtaléine d’une telle eau permet d’accéder au Bilans des réactions prépondérantes (le virage de la phénolphtaléine a lieu dans le domaine de prédominance de l’ion hydrogénocarbonate).
A l’équivalence, les ions hydronium (H3O+), présents dans la solution d’acide fort, et les ions antagonistes ont été introduits dans les proportions stœchiométriques.
Dans un erlenmeyer contenant 50 ml de l’échantillon, ajouter 2 gouttes de phénolptaléine.
- Si le pH < 8,2, la solution ne se colore pas en rose : le TA est = 0
- Si le pH > 8,2, la solution est rose : le TA est déterminé par addition de liqueur alcalimétrique (solution d’acide sulfurique (H₂SO₄) N/25), V (ml), nécessaire au virage de la phénolphtaléine (voir le cours TP : Préparation réactifs et étalonnages)
D’où : TA = V (ml) x 4°f avec V(ml) volume total de titrant versé
2. Titre Alcalimétrique Complet (T.A.C.)
2.1. Calculer le TAC
C’est le volume d’acide (en mL) à 0,02 mol.L – 1 en ions H3O+ nécessaire pour doser 100 mL d’eau en présence de méthylorange (encore appelé hélianthine).
Le T.A.C. s’exprime en degré français (°f). 1°f équivaut à à 3,4 mg/L d’ion hydroxyde (HO–) ou à 6 mg/L d’ion carbonate (CO32-) ou 12,2 mg/L d’ion hydrogénocarbonate (HCO3–).
Le Titre Alcalimétrique Complet (couramment appelé Alcalinité) d’une eau correspond à la présence d’espèces basiques telles que les ions hydroxyde (HO– ), les ions carbonate (CO32−), les ions hydrogénocarbonate (= bicarbonate) (HCO3– )
Egalement, c’est le volume d’acide (exprimé en mL) à 0,02 mol.L – 1 en ions H3O+ nécessaire pour doser 100 mL d’eau en présence de vert de bromocrésol.
Le TAC permet de stabiliser le pH à la valeur recommandée, c’est ce que l’on appelle le « pouvoir tampon ».
Mesure du TAC
Le dosage en présence de d’héliantine ou de vert de bromocrésol d’une telle eau permet d’accéder au Bilans des réactions prépondérantes (le virage de l’hélianthine comme celui du vert de bromocrésol se fait dans le domaine de prédominance de l’espèce CO2 dissous ).
A l’équivalence, les ions hydronium (H3O+), présents dans la solution d’acide fort, et les ions antagonistes ont été introduits dans les proportions stœchiométriques.
Elle succède à celle du TA sur le même échantillon.
Si le TA est non nul, ne pas réajuster la burette de liqueur alcalimétrique à zéro.
Dans l’échantillon précèdent, ajouter 3 gouttes d’hélianthine.
- Si le pH < 4,3, la solution est immédiatement rouge ou orangée : TAC = TA
- Si le pH > 4,3, la solution est jaune : le TAC est déterminé de la même manière que le TA
D’où : TAC = V(ml) X 4°f avec V(ml) volume total de titrant versé
2.2. Interprétation et correction du TAC
Une eau ayant une valeur de TAC correcte aura donc un pH relativement stable. L’eau de pluie (acide) peut contribuer à la diminution du TAC.
Pour avoir un pouvoir tampon suffisant, il est recommandé d’avoir un TAC compris entre 8°f (80mg/l) et 14°f (140mg/l).
En deçà de ce seuil, le pH risque de rester bas. Au delà de ce seuil, le pH risque d’être trop élevé et d’entartrer les installations.
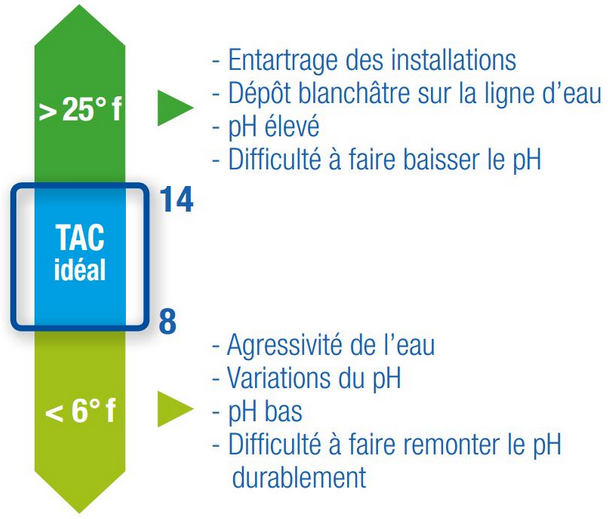
Pour augmenter le TAC (et le pH), le bicarbonate de soude (NaHCO₃), appelé aussi bicarbonate de sodium, est un composé chimique très utile dans l’entretien d’une installation.
Pour baisser le TAC (et le pH), l’acide chlorhydrique (HCl) est un acide très utile pour l’entretien des installation.
3. Diagramme de prédominance des espèces CO2 dissous , HCO3 – , CO32-
On donne les pKA des couples acido-basiques CO2 dissous / HCO3– et HCO3– / CO32- , à 298 K (=25°C)
pKA ( CO2 dissous / HCO3– ) = 6,35
et pKA (HCO3– / CO32- ) = 10,35
Ces valeurs permettent d’établir le diagramme de prédominance des espèces CO2 dissous , HCO3– , CO32-
On superpose à ce diagramme, les zones de virage des indicateurs colorés cités dans les définitions
précédentes.
Méthodologie
Diagramme de prédominance des espèces CO2 dissous , HCO3– , CO32-
On place le pKA sur l’échelle de pH, puis les espèces chimiques du plus acides au plus basiques. Enfin, on place les indicateurs colorés.
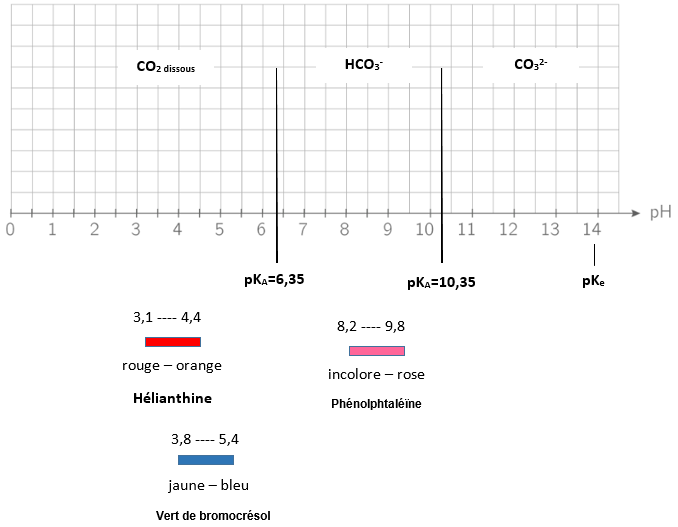
Les fontières de pédominances sont représentées par pKA1=6,35 et pKA2=10,35

Le dosage (en présence de phénolphtaléine) permet d’accéder à la concentration en ions carbonate et en ions hydroxyde de l’eau).
Le second dosage (en présence d’hélianthine ou en présence de vert de bromocrésol) nous permet d’accéder à la concentration totale en ces trois ions.
4. Le TAC et la santé
La présence d’anhydride carbonique (CO2 dissous) donne une saveur agréable à l’eau et ne présente aucun inconvénient pour la santé humaine.
Il n’existe pas de norme de potabilité relative à l’alcalinité. Toutefois, si une eau est trop agressive, elle peut entraîner la mise en solution de sels de cuivre et de plomb (risque de saturnisme par accumulation de plomb dans l’organisme). C’est pourquoi la Directive de la C.E.E. du 15 juillet 1980 recommande, pour les eaux de consommation ayant subi un
traitement d’adoucissement, une alcalinité minimale de 30 mg.L–1 de HCO3–, l’eau ne devant pas être agressive
Remarque : Dans les eaux potables, la concentration des ions hydroxyde (HO– ) est faible devant celle des ions hydrogénocarbonate (HCO3– ) et devant celle des ions carbonate (CO32−).
Le diagramme de prédominance vu préalablement, nous indique immédiatement qu’une eau riche en CO2 dissous sera assez acide (on dit « agressive »).
Par contre, une eau riche en ions carbonate sera dite « incrustante » (dépôt de carbonates insolubles).
Les eaux de surface, en contact avec l’atmosphère (pression voisine de un bar, atmosphère pauvre en dioxyde de carbone) sont souvent « à l’équilibre »; elles ne sont ni « incrustantes », ni « agressives ».
