Mathématiques
Les glucides
1. FORMATION DES GLUCIDES
Glucose, fructose, saccharose, lactose, amidon, cellulose,… tous ces composés appartiennent à la grande famille des glucides ou sucres.
Les glucides se forment naturellement au cours de la photosynthèse. C’est un processus très complexe qui s’effectue à partir de l’eau du sol et du dioxyde de carbone atmosphérique sous l’influence de la lumière. Le bilan peut être chématisé par l’équation de la réaction :

2. CLASSIFICATION
On classe les glucides en fonction de leur capacité à subir ou non une hydrolyse. On distinguera alors 2 classes de glucides : les osides et les oses.
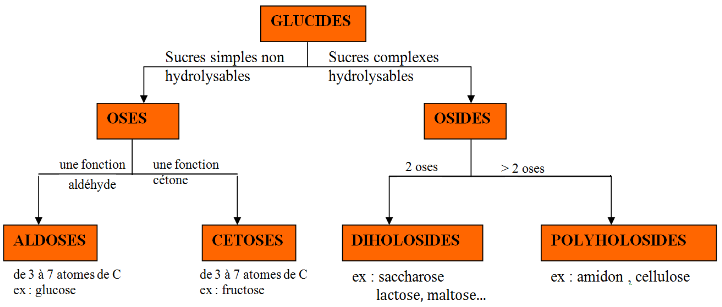
2.1. Propriétés des oses : le glucose et ses isomères
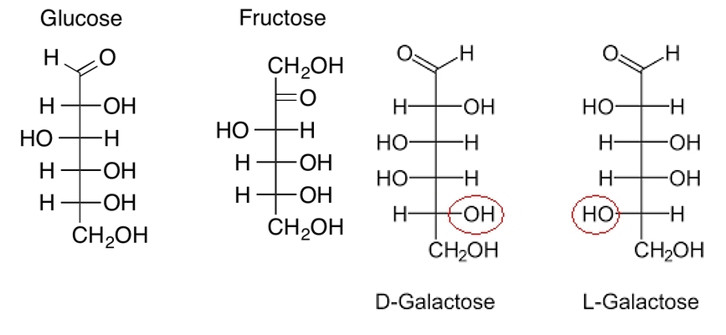
Les oses peuvent etre représentées sous une forme cyclique
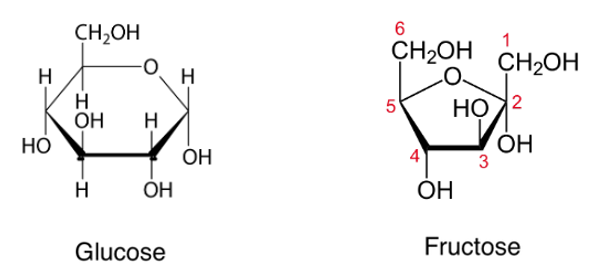
2.2. Propriétés des osides
Ce sont des glucides complexes formés de plusieurs molécules d’oses. Les osides sont hydrolysables. On peut les classer en 2 catégories :
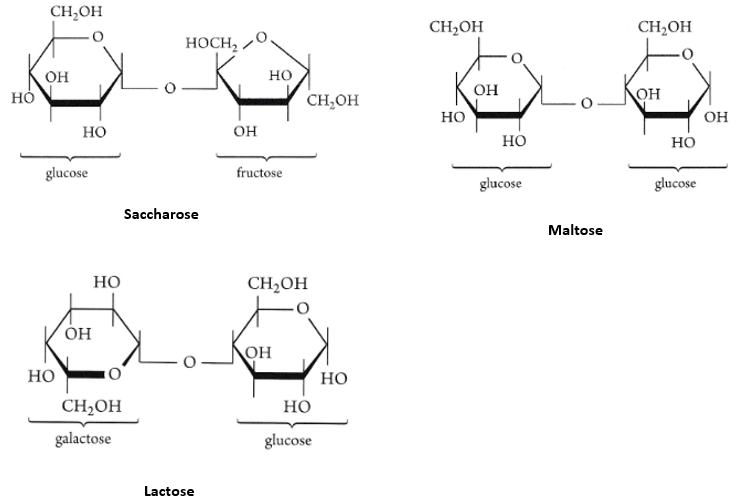
2.2.1. Les diholosides
Leur hydrolyse conduit à la formation de deux oses (réaction en milieu acide)
Exemple : saccharose + eau → glucose + fructose
C12H22O11 + H2O → C6H12O6 + C6H12O6
2.2.2. Les polyholosides : L’amidon et ses isomères
La formule générale de l’amidon et ses isomères est : (C6H10O5)n avec 500<n<30000. Leur hydrolyse conduit à un diholoside puis à un ose.
Exemples :
L’amidon, présent dans les féculents, n est compris entre 500 et 1000. Son hydrolyse conduit à lafformation du maltose, puis du glucose selon le schéma :
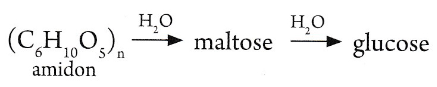
Le glycogène rencontré dans le foie et dans les muscles et qui joue le rôle de réserve glucidique du monde animal, n est de l’ordre de 30000 . Son hydrolyse conduit à la formation du glucose.

La cellulose est principalement répandue dans le monde végétal (membrane des cellules végétales, bois, le coton, le lin, …). n est compris entre 1000 et 5000. Son hydrolyse est difficile et facilitée grâce à l’action d’une enzyme, l’amylase et conduit à la formation du gulcose selon le même schéma réactionnel que le glycogène.

3. TESTS CHIMIQUES
3.1. Test de la liqueur de Fehling
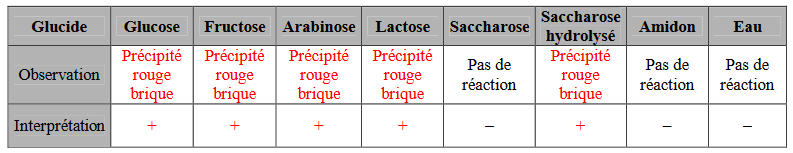
Le test à la liqueur de Fehling met en évidence la présence de certains sucres comme le glucose.
La liqueur de Fehling (A et B) est destinée au dosage des sucres résiduels. Une fois préparée (mélange en quantités égales des solutions A et B), sa concentration est telle que 10 ml sont décolorés par 0,05 g de sucres résiduels. Sa conservation est de 12 mois et de 3-4 mois après ouverture.
- Solution A: 70 g de CuSO4.5H2O dans 1 L d’eau distillée
- Solution B: 350 g de tartrate mixte de Na/K.4H2O et 100 g de NaOH dans 1 L d’eau distillée
Le test est positif car il se forme un précipité rouge brique caractéristique.
La liqueur de Fehling est une solution basique qui contient des ions [CuT2]2-(aq), constitués d’ions cuivre (II) Cu2+ et d’ions tartrate, notés T2- pour simplifier. La solution est bleue.
Dans un tube à essai, introduire environ 2 mL de liqueur de Fehling. Ajouter une dizaine de gouttes de la solution à tester ou morceau de pomme. Placer le tube à essais dans un bain-marie à environ 60°C. Noter vos observations.
Principaux résultats

3.2. Test au réactif de Tollens
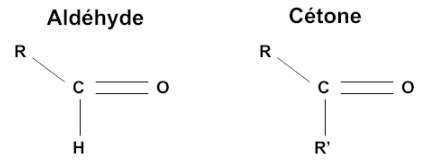
La réaction de Tollens est une réaction caractéristique des aldéhydes. Ceci du fait des propriétés réductrices des aldéhydes, que n’ont pas les cétones.
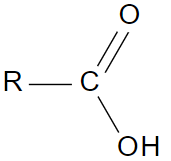
Pour la majeure partie la solution de Tollens est un complexe de nitrate d’argent en solution ammoniacale ([Ag(NH3)2]+ ; NO3–). Au cours de la réaction l’ion argent I oxyde l’aldéhyde pour donner un acide carboxylique selon la réaction bilan d’oxydo-réduction générale : R-CHO + 2Ag+ (aq) + 3HO– → RCOO– + 2Ag (s) + 2H2O
Un dépôt d’argent se forme alors sur les parois évoquant un miroir. Cette réaction se nomme aussi «test du miroir d’argent». Il s’agit d’un procédé d’argenture utilisé par exemple pour les boules des sapins de Noël.
Les cétones qui ne peuvent être oxydées en acide carboxylique ne réagissent pas au test de Tollens.
3.3. Test à l’eau iodée (ou Lugol)
Il s’agit d’un réactif de couleur orangée permettant la mise en évidence des POLYOSES (sucres « complexes » comme l’amidon, le glycogène). La solution d’iodure de potassium KI à 10% dans laquelle on dissout de l’iode I2 à saturation.
Cette solution que l’on peut diluer jusqu’à obtention d’une couleur jaune paille ou « jus de pomme », réagit à froid en présence d’amidon pour donner un composé rouge vineux foncé à pourpre noirâtre. Le Lugol ou IKI est donc destiné à mettre en évidence la présence d’amidon.
En réagissant avec ces glucides, l’eau iodée initialement de couleur jaune-orangé change instantanément de couleur :
– noir-violacé en présence d’amidon,
– brun en présence de glycogène.
– Prélever 2-3 ml de solution à tester puis verser ce volume dans un tube à essai,
– Ajouter ensuite 1-2 gouttes d’eau iodée. Noter vos observations.
4. ROLE BIOLOGIQUE
L’énergie chimique du glucose n’est pas directement utilisable par notre organisme.
La respiration et la fermentation sont 2 types de réaction biologiques qui permettent la conversion de l’énergie chimique contenue dans le glucose en une autre forme d’énergie directement utilisable par la cellule.
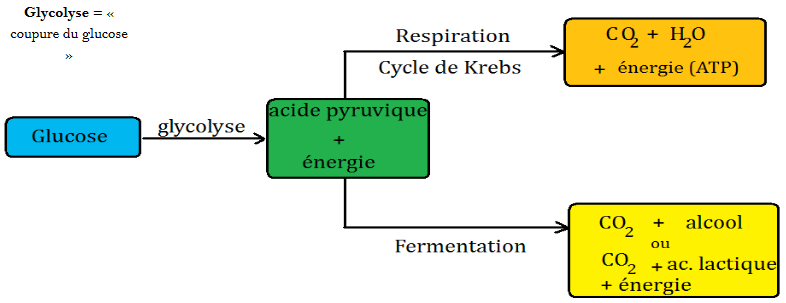
La fermentation est une réaction d’oxydoréduction qui se produit en absence d’oxygène. On parle de fermentations anaérobiques. Les réaction de fermentation s’effectuent sous l’action des enzymes.
Fermentation alcoolique : C6H10O6 → 2CO2(g) + 2C2H5OH
Cette réaction se produit grâce aux enzymes secrétées par des levures. Elle est à l’origine de la fabrication du pain et de toutes les boissons alcoolisées.
Fermentation Lactique : C12H22O11+ H2O → C6H12O6 + C6H12O6
Catalysée par les enzymes secrétés par des bactéries. Cette réaction a lieu dans les muscles quand ils ne sont pas assez oxygénés par le sang. Elle provoque les crampes.
Elle permet aussi la transformation du lait en yaourt. En effet le lactose du lait se transforme en acide lactique. Cela provoque la coagulation des protéines du lait.
