Mathématiques
Formation des molécules et des ions monoatomiques courants
I – Établir la structure électronique d’un atome
- Sur des couches électroniques
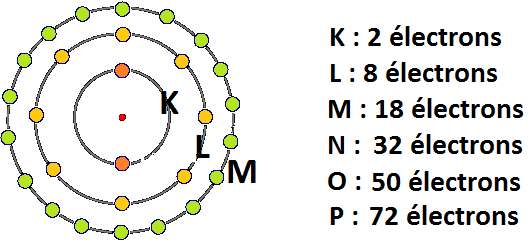
- autour du noyau, les électrons se répartissent sur des couches électroniques
- chaque couche est représentée par une lettre. De la plus proche à la plus éloignée de noyau,
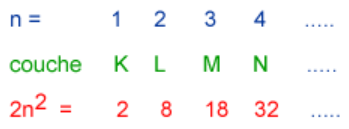
nous avons : K, L M… - chaque couche contient un nombre limité d’électrons : 2 sur la couche K, 8 sur la couche L et 18
sur la couche M - quand une couche est complète, elle est dite saturée.
Attention ! La couche M connaît un premier seuil de saturation quand elle contient 8 électrons
2. Règles de remplissage
Les couches se remplissent de la plus proche à la plus éloignée du noyau. Avant de passer au remplissage de la couche suivante, la précédente doit être complète. Ces règles s’appliquent si le nombre d’électrons ne dépassent pas 18.
3. La couche externe
La couche externe est la dernière couche remplie. Comme elle contient les électrons les plus éloignés du noyau, connaître le nombre d’électrons qu’elle porte permet de prévoir l’évolution d’un atome dans une réaction chimique.
4. Exemples
Li : Z = 3, soit 3 électrons (K)2 (L)1 soit 1 électron sur la couche externe
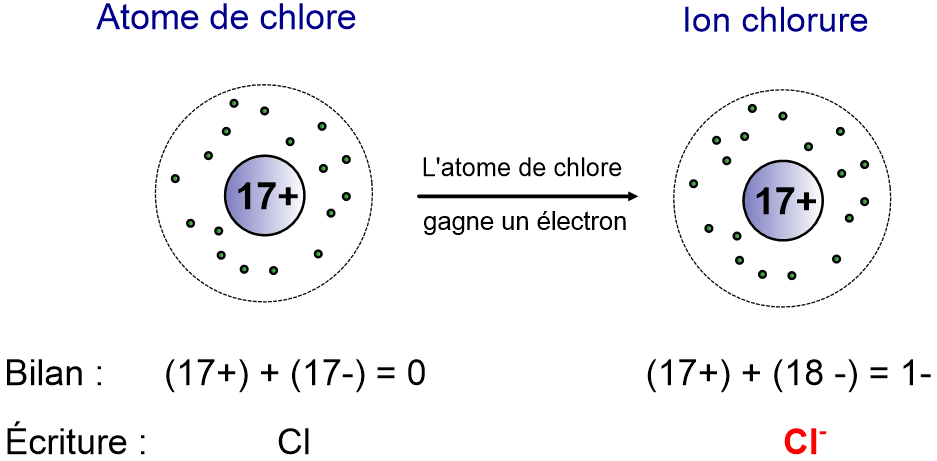
Cl : Z = 17, soit 17 électrons (K)2 (L)8 (M)7 soit 7 électrons sur la couche externe
Cl– : Z = 17 mais il y a 18 électrons (K)2 (L)8 (M)8 soit 8 électrons sur la couche externe
Dans le cas de l’ion chlorure, la couche M est saturée, qu’est-ce que ça change ?
On trouve des ions chlorure dans la nature mais pas de chlore sous forme atomique. Les ions chlorure sont donc des espèces stables et pas le chlore.
5. Quelles autres espèces chimiques ont leur couche externe saturée ?
Ce sont les gaz nobles : hélium (He), néon (Ne), argon (Ar), krypton (Kr).
Ce sont des espèces chimiques très stables qui existent sous forme de gaz monoatomique dans la nature et qui ne forment pas d’ions et ne participent à quasiment aucune réaction chimique.
He : Z = 2 soit 2 électrons (K)2
Ne : Z = 10 soit 10 électrons (K)2 (L)8
Ar : Z = 18 soit 18 électrons (K)2 (L)8 (M)8
C’est la saturation de la couche externe qui confère aux gaz nobles leur grande stabilité avec :
- soit 2 électrons sur la couche K
- soit 8 électrons sur la couche L ou M
II- Règles du duet et de l’octet
Pour devenir stable, les éléments adoptent la structure du gaz noble le plus proche soit en perdant soit en gagnant un ou plusieurs électrons. Si le gaz noble le plus proche est l’hélium, on applique la règle du duet. Si les gaz nobles les plus proches sont le néon ou l’argon, on applique la règle de l’octet.
Comment les atomes respectent-ils ces règles ?
- soit en formant des ions monoatomiques (ou polyatomiques, hors programme) ;
- soit en formant des molécules.
Une molécule résulte de l’association d’au moins deux atomes. Cette association permet à chacun des atomes de respecter la règle du duet ou de l’octet et donc de s’entourer de deux ou huit électrons.
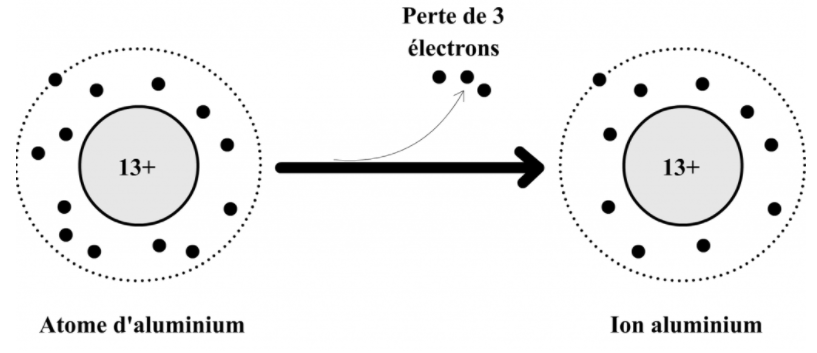
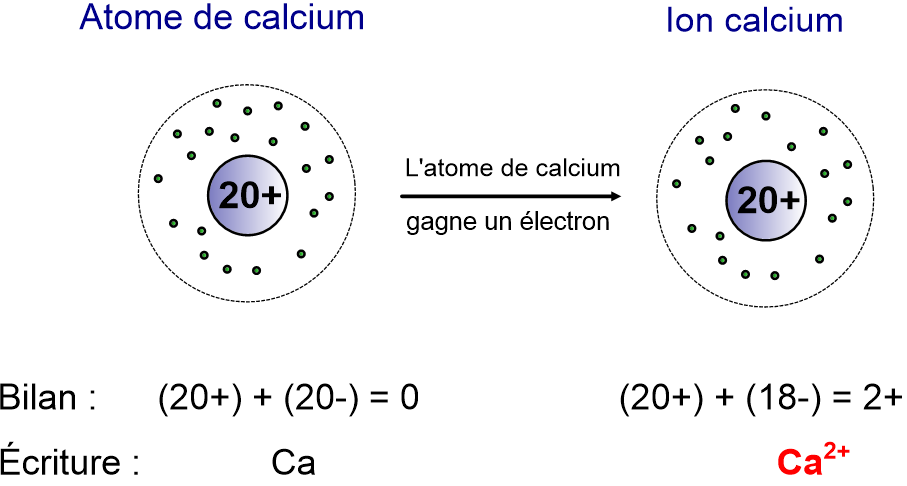
III- Transformation d’un atome en ion positif (cation)
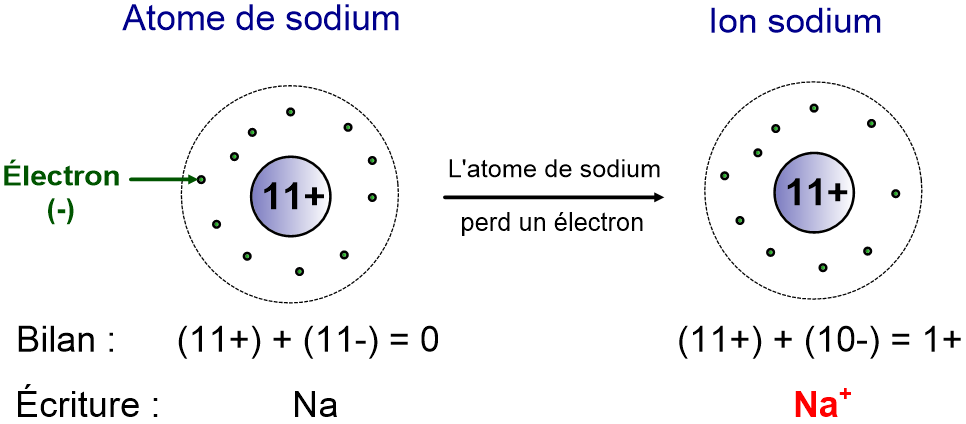
IV- Transformation d’un atome en ion négatif (anion)
V- Les ions polyatomiques
Les ions peuvent également se former à partir d’ensembles de plusieurs atomes qui perdent ou gagnent un ou plusieurs électrons. Ces ions sont alors appelés des ions polyatomique ( poly = plusieurs et atomique dérive d’atome).
Exemples d’ions polyatomique
- L’ion sulfate de formule SO42-
- L’ion carbonate de formule CO32-
Ils sont formés par un groupement de plusieurs atomes. La charge positive ou négative s’applique à l’ensemble des atomes du groupe.
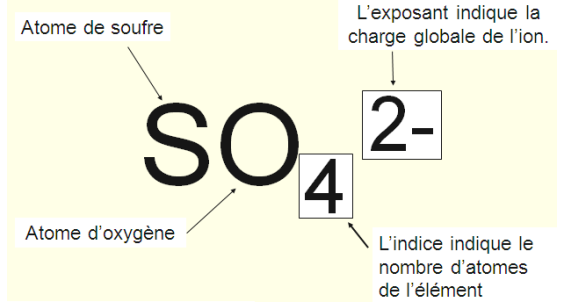
L’ion sulfate est composé de : 1 atome de soufre et 4 atomes d’oxygène. L’ensemble porte la charge électrique 2-.
L’ion sulfate est un groupement d’atomes qui a gagné 2 électrons.
