Mathématiques
Conductivité et potentiel hydrogène (pH)
1. Définition du pH (potentiel hydrogène)
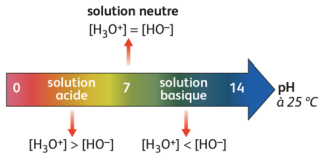
Le potentiel hydrogène, noté pH, d’une solution est lié à la concentration des ions oxonium [H3O+] par la
relation suivante : pH= – log[H3O+]
[H3O+] est exprimée en mol.L-1 et « log » désigne le logarithme décimal.
La mesure du pH permet de calculer la concentration en ions oxonium par la relation : [H3O+] = 10-pH
La valeur de [H3O+] ainsi obtenue s’exprime en mol.L-1
2. Les acides et les bases
2.1. Acide et base de Brönsted
Un acide de Brönsted est une espèce chimique susceptible de libérer des protons H+ dans un milieu.
L’acide chlorhydrique de formule HCl est un acide au sens Brönsted car il se dissocie dans l’eau en ions Cl– et H+ (qui sont sous forme d’ions oxonium H3O+ en solution aqueuse). Il libère donc des protons H+.
Une base de Brönsted est une espèce chimique susceptible de capter des protons H+ d’un milieu.
La soude de formule NaOH se dissocie dans l’eau en ions Na+ et HO– (ions hydroxydes). Ces ions hydroxydes vont réagir avec des protons de pour former l’eau. La soude est une espèce susceptible de capter des protons donc elle est une base selon Brönsted.
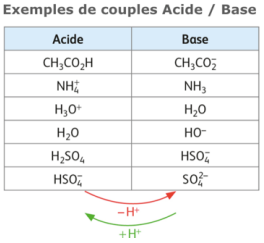
2.2. Couple acide / base
Lorsqu’un acide AH est mis dans l’eau, il se dissocie suivant la réaction : AH + H2O → A– + H3O+
L’espèce chimique A– s’appelle la base conjuguée de l’acide AH. L’acide et la base conjuguée forment un couple acido-basique : AH / A– (Analogue à un couple oxydo-réduction)
2.3. Cas particulier de l’eau
L’eau est à la fois un acide et une base qui intervient dans deux couples acido-basiques.
- H2O est une base de Brönsted du couple H3O+ / H2O : H2O + H+→ H3O+
- H2O est un acide de Brönsted du couple H2O / HO– : H2O → HO– + H+
On dit que l’eau est une espèce amphotère et ou que c’est un ampholyte (Il en existe d’autres). Toutes les solutions aqueuses contiennent des ions oxonium H3O+ et des ions hydroxyde HO– .
En effet, dans l’eau, une faible quantité de molécules d’eau se dissocient toujours en ions H3O+ et HO–. C’est la réaction d’autoprotolyse de l’eau qui est une réaction entre l’eau en tant qu’acide et l’eau en tant que
base et qui s’écrit : 2 H2O → H3O+ + HO–
On constate expérimentalement que le produit des concentrations des ions oxonium H3O+ et des ions hydroxyde HO– est toujours égal à une constante à une température fixe. Cette constante, sans dimension, est notée Ke et est appelée produit ionique de l’eau.
Ke = [H3O+].[HO–]
A la température de 25°C (ambiante) Ke = 10-14 . Ainsi, lorsque l’une des concentrations en ions H3O+ou HO– augmente, l’autre diminue puisque leur produit reste constant. On note pKe la constante égale à -log (Ke) ; pKe = 14,0 à 25 °C.
3. L’équilibre acido-basique
3.1. Les acides forts et les bases fortes
Les acides forts et les bases fortes sont des acides et des bases pour lesquels la réaction avec l’eau est totale :
Acide fort AH : AH + H2O → A– + H3O+
Base forte A- : A– + H2O → AH + HO
L’équation d’une réaction totale s’écrit avec une flèche →.
Exemples :
- Acide fort : l’acide chlorhydrique HCl, l’acide sulfurique H2SO4, l’acide nitrique HNO3,
- Base forte : la soude NaOH, la potasse KOH
3.2. Les acides et les bases faibles
Les acides et les bases faibles sont des acides et des bases pour lesquels la réaction avec l’eau n’est pas totale. Les réactions sont dites équilibrées.
Acide faible AH : AH + H2O ⇌ A– + H3O+
Base faible A- : A– + H2O ⇌ AH + HO–
L’équation d’une réaction équilibrée s’écrit en utilisant deux flèches de sens opposé ⇌.
Exemples : Acide faible : Acide éthanoïque CH3COOH ; Base faible : éthanoate CH3COO–
État d’équilibre chimique : une réaction atteint son état d’équilibre chimique lorsque le système n’évolue plus alors que tous les réactifs sont encore présents. Cet état est caractérisé par une constante d’équilibre.
3.3. La constante d’acidité
La constante d’acidité Ka est la constante qui caractérise la réaction de dissociation d’un acide faible AH :
AH + H2O ⇌ A– + H3O+
La constante d’acidité Ka d’un couple acido-basique AH / A- est donnée par la relation :
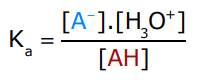
Exemple : la constante d’acidité de l’acide éthanoïque est 1,8.10-5 . Pour des raisons de commodité, on utilise souvent le pKa ; pKa = – log(Ka)
Exemple : pKa de l’acide éthanoïque = – log(1,8.10-5) = 4,8
