Physique – Chimie
Transformation physique
1. Changements d’état des corps purs
Un corps pur peut être dans trois états physiques en fonction de sa température et de la pression :
• Solide
• Liquide
• Gazeux
Le passage d’un état à l’autre se fait à des températures précises selon le corps étudié, appelées températures de changement de phase.
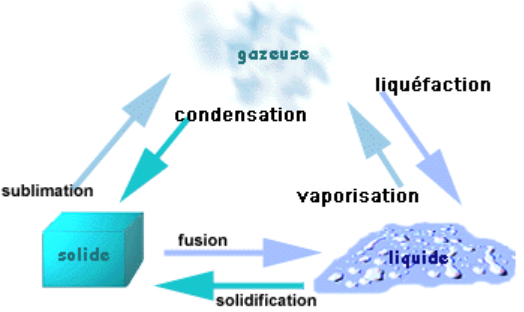
Le passage d’une phase à l’autre porte un nom spécifique, selon la phase de départ et celle d’arrivée.
• gaz : état dispersé, désordonné
• liquide : état compact et désordonné
•solide : état compact et ordonné
Lors d’un changement d’état d’un corps pur, à température constante et pression donnée, les deux états coexistent simultanément.
2. Diagramme d’état (P, T)
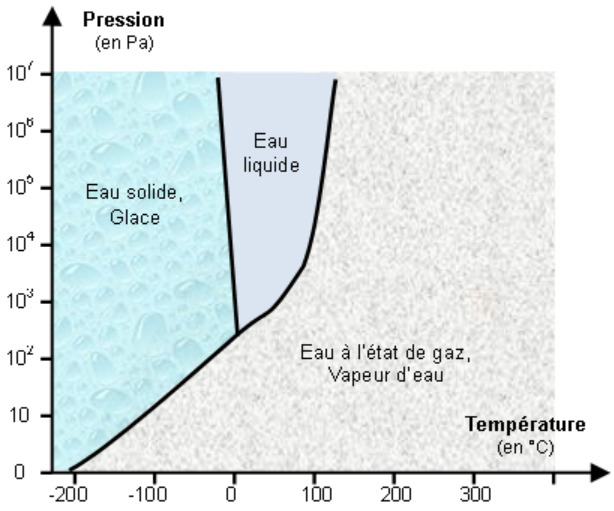
Lors d’un changement d’état d’un corps pur, à température constante (T) et pression donnée (P), les deux états coexistent simultanément.
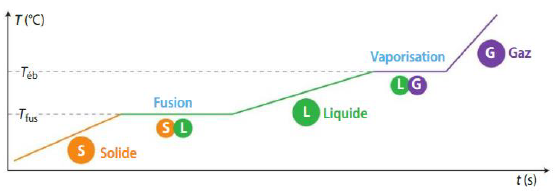
Pour un changement d’état:
• Lors du passage solide → liquide → gaz, la structure de la matière est de plus en plus désordonnée.
• Lors du passage gaz → liquide → solide la structure de la matière se caractérise par un état de plus en plus ordonné.
3. Enthalpie de changement d’état
L’enthalpie de changement d’état ou chaleur latente d’une masse (L) ou d’une quantité de matière est la quantité d’énergie (Q) qu’il faut lui communiquer pour qu’elle passe de l’état initial (solide, liquide ou gazeux) à un autre état.
Q= m. L
Avec quantité d’énergie Q en Joule (J), masse m en (kg) et chaleur latente de fusion ou de vaporisation L en (J.kg-1)
3.1. Les transformations exothermiques
Les transformations exothermiques sont des réactions qui dégagent de l’énergie, augmentant ainsi le degré énergétique de leur milieu. Cela peut être perceptible par une augmentation de température ou dégagement de lumière.
Lors d’une solidification, d’une liquéfaction ou d’une condensation, l’espèce chimique change d’état et son énergie diminue, alors que celle du milieu extérieur augmente. La transformation est exothermique (Q < 0) et le milieu extérieur se réchauffe.
solidification : corpsliquide → corpssolide + Q
liquéfaction : corpsgaz → corpsliquide + Q
condensation solide : corpsgaz → corpssolide + Q
On reconnaît une réaction exothermique lorsque, dans une équation chimique, la valeur énergétique est intégrée du côté des produits de la réaction, à droite de la flèche.
Lorsqu’une réaction chimique dégage de la chaleur dans un milieu, la température de ce milieu augmente. La température finale est donc plus élevée que la température initiale.
3.2. Les transformations endothermiques
Les transformations endothermiques sont des réactions qui, en absorbant de l’énergie, abaissent le degré énergétique du milieu. Cela peut être perceptible par une baisse de température dans le milieu.
Lors d’une fusion, d’une vaporisation ou d’une solidification, l’espèce chimique change d’état et son énergie augmente, alors que celle du milieu extérieur diminue. La transformation est endothermique (Q > 0) et le milieu extérieur se refroidit.
fusion : corpssolide + Q → corpsliquide
vaporisation : corpsliquide + Q → corpsgaz
sublimation : corpssolide + Q → corpsgaz
On reconnaît une réaction endothermique lorsque, dans une équation chimique, la valeur énergétique est intégrée du côté des réactifs de la réaction, à gauche de la flèche.
Lorsqu’une réaction chimique absorbe de la chaleur dans un milieu, la température de ce milieu diminue. La température finale est donc moins élevée que la température initiale. C’est donc le milieu environnant qui est responsable de ce transfert d’énergie.
L’énergie de fusion Qf (J) est l’énergie nécessaire pour faire fondre une masse m (kg) d’un corps pur d’énergie massique de fusion Lf (J.kg−1) : Qf = m × Lf
L’énergie de vaporisation Qv (J) est l’énergie nécessaire pour vaporiser une masse m (kg) d’un corps pur d’énergie massique de vaporisation Lv (J.kg−1) : Qv = m × Lv
3.3. Capacité thermique massique ou chaleur massique (cm)
La capacité thermique massique d’une substance, est une propriété caractéristique. Elle donne la capacité précise de cette substance d’absorber ou de dégager de la chaleur.
la capacité thermique massique est la quantité de chaleur qu’un gramme d’une substance doit absorber pour que sa température s’élève d’un degré Celsius. Il peut s’agir aussi de la quantité de chaleur qu’un gramme de cette substance doit perdre pour que sa température baisse d’un degré Celsius.
L’unité de mesure de la capacité thermique massique est le J.kg-1·K-1.
Relation entre température θ (degré Celcius ; °C) et tempérarure absolue (Kelvin ; K) :
T = 273,16 + θ
Étant donné qu’il s’agit d’une propriété caractéristique, la capacité thermique massique est propre à chaque substance.
Ainsi, plus la capacité thermique massique d’une substance est élevée, plus il faut la chauffer pour augmenter sa température.
Au contraire, une substance ayant une faible capacité thermique massique se réchauffe rapidement, mais elle se refroidit aussi rapidement.
3.4. Chaleur de réaction en solution aqueuse
La chaleur d’une réaction est proportionnelle à la masse de la substance impliquée ainsi qu’à l’écart de température observé et à la nature de la substance.
Ainsi, pour calculer la quantité d’énergie transférée ou dégagée sous forme de chaleur, on utilise la relation suivante :
Q = m×c×△T
Avec Q : Quantité d’énergie transférée en joules (J) ; m : Masse de la substance en grammes (g) ; c: Capacité thermique de la substance en joules par kilogramme par kelvin (J.kg-1·K-1) ; △T: représente la variation de température (Tfinale−Tinitiale) en K
Par convention, une valeur d’énergie négative (-Q) est considérée comme de l’énergie dégagée alors qu’une valeur d’énergie positive (+Q) correspond à de l’énergie absorbée.
3.5. Valeur en eau du calorimètre
En calorimétrie, la valeur en eau (ou équivalent en eau) d’un corps est la masse d’eau fictive µ qui a la même capacité thermique que le corps :
µ = Cm / ceau
Avec µ : valeur en eau du calorimètre (kg) ; Cm : Capacité thermique du corps (J.K-1) ; ceau = 4185 J.kg-1·K-1: Chaleur massique de l’eau
