Physique – Chimie
Représentation de molécules simples selon le modèle de Lewis
Intoduction
La représentation d’un atome ou d’une molécule évolue au cours des années, selon l’avancée des connaissances.
Elle débute avec le modèle de Bohr (1913). Elle sera complétée par le modèle de Lewis, puis de Shrödinger.
Le modèle de Bohr, un modèle obsolète
Le modèle de Bohr est essentiellement résumé par ces trois hypothèses :
• Les électrons dans les atomes suivent des orbites circulaires autour du noyau
• les électrons ne peuvent orbiter autour du noyau qu’à des distances spécifiques où leur moment angulaire obéit à l’équation : L=𝑛.ℏ
où 𝐿 est la quantité de mouvement angulaire d’un électron en orbite,
𝑛 est un entier positif appelé « nombre quantique principal » désignant le niveau d’énergie de l’électron (𝑛=1 correspond à l’état d’énergie la plus basse)
et ℏ=1,05×10-34 J.s est la constante de Planck réduite.
• Pour monter à une autre orbite plus éloignée du noyau (de plus haute énergie), un électron doit absorber de l’énergie sous la forme d’un photon. Inversement, un électron qui descend vers une orbite plus proche du noyau (de plus faible énergie) émettra de l’énergie sous la forme d’un photon.
Les couches électroniques dans l’atome
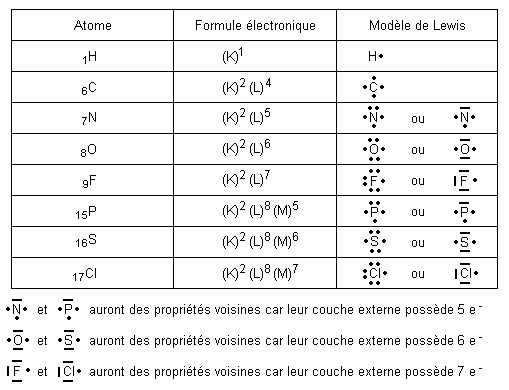
Les électrons des atomes se répartissent autour du noyau sur différentes couches électroniques, notées (K,L,M,…). Les couches électroniques correspondent à des niveaux d’énergie que les électrons occupent. Une couche est saturée lorsqu’elle contient son nombre maximal d’électrons.
Une couche électronique ne peut excéder un nombre d’électron égale à 2n2 , avec n le rang de la couche électronique.

Exemple du Carbone
Du schéma de l’atome de carbone, la structure électronique de l’atome de carbone sera : K2L4
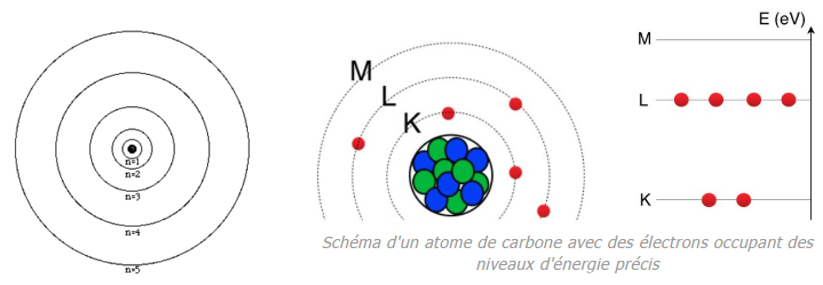
La dernière couche remplie est appelée couche externe et les électrons qui la composent sont appelés électrons externes ou de valence.
Le modèle de Lewis
Lewis représente en deux dimensions la structure électronique externe des atomes composant une molécule.
Règle du duet
Au cours de leurs transformations chimiques, les atomes caractérisés par Z ≤ 4 évoluent de manière à saturer
leur couche (K). Ils acquièrent un « duet » d’électrons, c’est-à-dire une paire d’électrons.
Règle de l’octet
Au cours de leurs transformations chimiques, les atomes caractérisés par Z > 4 évoluent de manière à saturer
leur couche externe (L) ou (M), etc…. Ils acquièrent un « octet » d’électrons, c’est-à-dire 8 électrons ou 4 paires
d’électrons.
Détermination du nombre de liaisons possibles

Exemple du carbone :
L’atome de carbone contient 6 électrons. ( numéro atomique Z = 6. )
La structure électronique de l’atome de carbone est : K2L4 , soit p=4
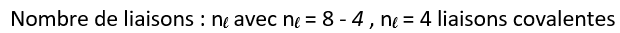

Le carbone possède 4 liaisons covalentes qui formeront 4 doublets liants (doublets mis en commun entre deux atomes). Les doublets liants assurent les liaisons entre les atomes.
Exemple de l’oxygène :
L’atome d’oxygène contient 8 électrons. ( numéro atomique Z = 8. )
La structure électronique de l’atome d’oxygène est : K2L6 , soit p=6
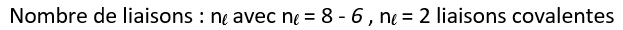

L’oxygène possède des doublets non liants. C’est-à-dire des paires d’électrons qui ne servent pas de liaisons entre deux atomes.
Exemple de l’hydrogène :
L’atome d’hydrogène contient 1 électron. ( numéro atomique Z = 1. )
La structure électronique de l’atome d’oxygène est : K1 , soit p=1
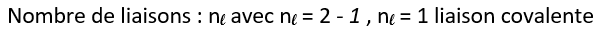
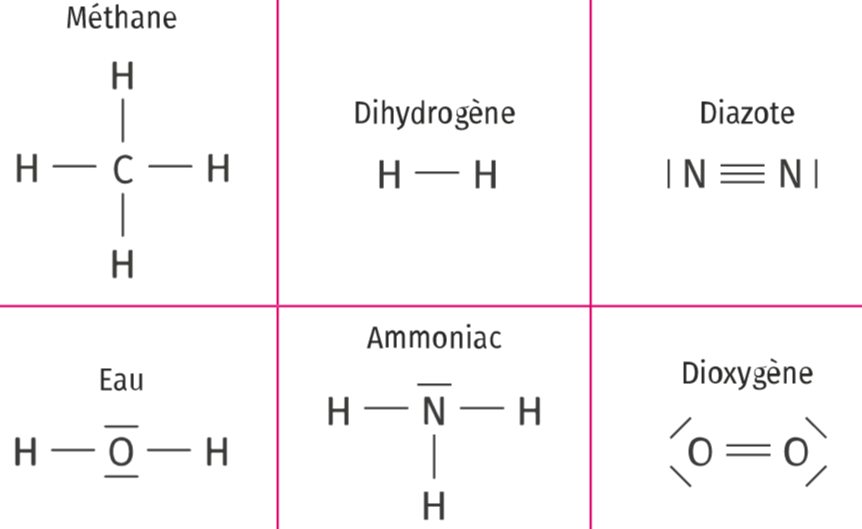
Exemples de représentation d’atomes selon le modèle de Lewis
Exemples de représentation de molécules simples selon le modèle de Lewis
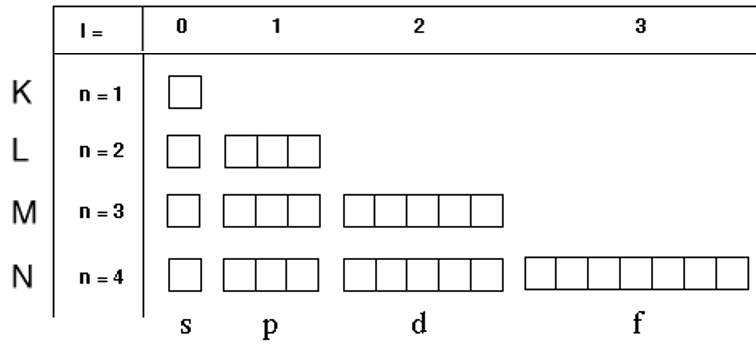
Couche électronique (s, p, d, f) un nouveau modèle
Le premier représente le nombre quantique n qui définit la couche électronique, tandis que la lettre correspond à une valeur de ℓ définissant la sous-couche électronique
- s correspond à ℓ = 0, pour sharp ou simple ;
- p correspond à ℓ = 1, pour principal ;
- d correspond à ℓ = 2, pour diffuse ;
- f correspond à ℓ = 3, pour fine ou fundamental
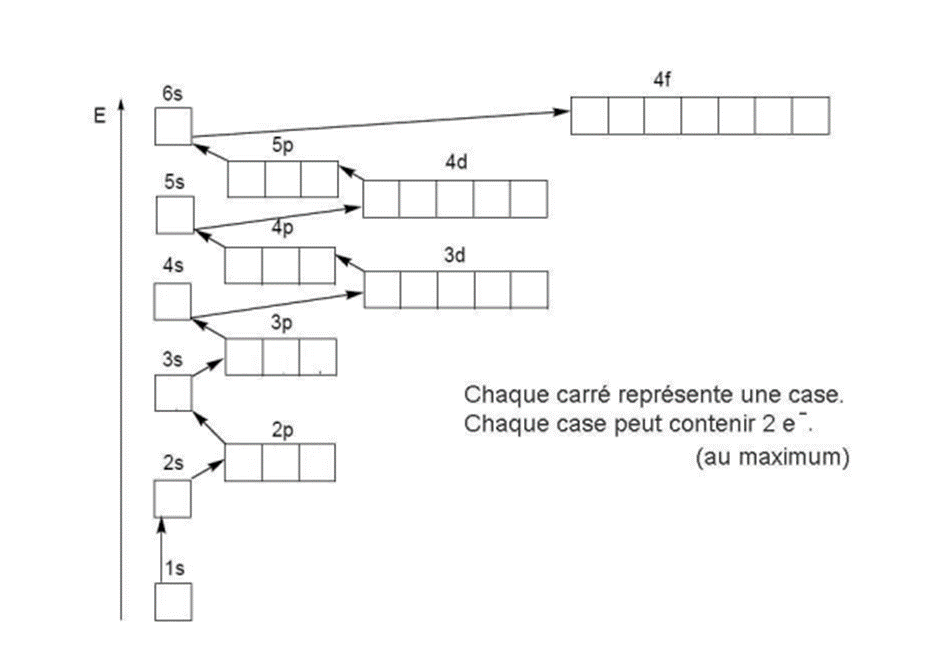
Méthode de remplissage des sous-couches s p d f
La Règle de Klechkowski
Principe d’exclusion de Pauli :
deux électrons d’un même atome ne peuvent être dans le même état quantique (ie se voir attribuer les cinq mêmes nombres quantiques). Il s’agit d’une règle rigoureuse, sans exception aucune.

Règle de Hund :
Pour une sous‐couche donnée, la configuration électronique de plus basse énergie est obtenue en plaçant un maximum d’électrons de même spin dans des orbitales différentes (Principe d’exclusion de Pauli), avant d’apparier des électrons de spins opposés.

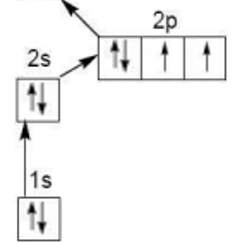
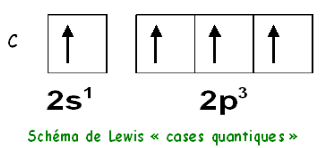
Exemple du carbone :
La structure électronique de l’atome de carbone sera : 1s2 2s 23p2 . Dans son état fondamental, le carbone possède deux électrons célibataires et sa valence est donc de deux.
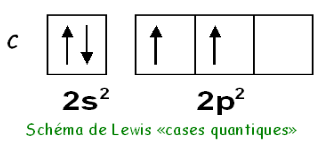
Mais, il est très généralement dans son état excité 2s1 2p3, il possède alors quatre électrons célibataires et sa valence est de quatre.
Exemple de l’oxygène :
La structure électronique de l’atome d’oxygène sera : 1s2 – 2s2 – 2p4 .