Physique – Chimie
Réaction chimique, Bilan de matière simple, Tableau d’avancement
Le bilan de matière est le calcul qui conduit à préciser la quantité de matière en moles disparues de chaque réactif et la quantité en moles de chaque produit qui apparaît.
1. Signification de l’équation chimique à l’échelle microscopique (molécule)
Considérons l’équation de la réaction de combustion du méthane (gaz de ville) :
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (l)
Avec (g) : état gazeux et (l) : état liquide
D’un point de vue microscopique, elle signifie que lorsqu’une molécule de méthane (CH4) rencontre deux molécules de dioxygène (O2) alors il se forme une molécule de dioxyde de carbone (CO2) et deux molécules d’eau (H2O).
2. Signification de l’équation chimique à l’échelle macroscopique (mole)
Mais la chimie ne se limite pas au monde microscopique : on ne manipule pas une ou deux molécules mais un nombre inimaginable. Le chimiste manipule en réalité des moles. Cependant, le lien est assez simple à établir car une mole est l’unité légale de mesure qui représente un ensemble de 6.1023 espèces chimiques identiques.
Mais, quel est ce nombre ?
Le Nombre d’Avogadro
Jusqu’au 20 mai 2019, le nombre d’Avogadro (donc aussi la mole) est défini comme le nombre d’atomes de carbone dans 12 grammes (10−3 kg) de carbone 12, le kilogramme étant lui-même défini comme la masse d’un étalon international. Sa valeur est mesurée à :
NA = 6,022 140 857(74) × 1023 mol−1.
À partir du 20 mai 2019, le nombre d’Avogadro devient une constante fixée par convention, qui définit la mole :
NA = 6,022 140 76 × 1023 mol−1, exactement.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (l)
Dans ces conditions, on peut tout aussi bien dire que : 1 mole de méthane (CH4) réagit avec deux moles de dioxygène (O2) pour donner 1 mole de dioxyde de carbone (CO2) et 2 moles d’eau (H2O).
D’un point de vue pratique, on dira même que lorsque 1 mole de méthane (CH4) disparaît, alors 2 moles de dioxygène (O2) disparaissent en même temps et 1 mole de dioxyde de carbone (CO2) apparaît avec 2 moles d’eau (H2O).
En allant plus loin, puisque le chimiste ne manipule pas nécessairement un nombre entier de quantité de matière :
Lorsque x moles de méthane disparaissent avec 2x moles de dioxygène, il se forme x moles de dioxyde de carbone et 2x moles d’eau.
Enfin, Le nombre stœchiométrique du méthane (CH4) est 1, celui de dioxygène (O2) est 2, celui du dioxyde de carbone (CO2) est 1 et celui de l’eau (H2O) est 2.
3. Le bilan de matière
L’exploitation de l’équation de la réaction chimique est la première étape du bilan de matière. En effet, à partir de ce constat, on doit être capable de déterminer :
- quel réactif disparaît totalement (réactif limitant)
- la quantité en moles du ou des réactifs en excès qui reste en fin de réaction
- la quantité en moles de chaque produit qui apparaît.
Par exemple :
Si je réalise la combustion de 0,5 mole de méthane dans 2,5 moles de dioxygène : tout le méthane disparaît pour donner 0,5 mole de dioxyde de carbone et 1 mole d’eau sachant qu’il reste 1,5 mole de dioxygène. Le méthane est donc le réactif limitant et le dioxygène, le réactif en excès.
4. Le tableau d’avancement
Le tableau d’avancement permet de dresser un bilan de matière à tout instant, c’est-à-dire de calculer les quantités de matière des réactifs et des produits à l’état initial, dans un état intermédiaire ou dans l’état final.
Dans un tableau d’avancement, la première ligne présente l’équation ajustée de la réaction qui modélise la transformation réalisée.
Puis les autres lignes donnent les quantités de matière des espèces chimiques pour différents états de la transformation :
– l’état initial à t = 0 s pour lequel l’avancement est nul (x = 0)
– l’état en cours de transformation pour lequel l’avancement est noté x
– l’état final caractérisé par un avancement x f.
Exemple 1 : pour la réaction entre le méthane (CH4) et le dioxygène (O2)
Avec 3 mol de méthane (CH4) et 5 mol de dioxygène (O2)
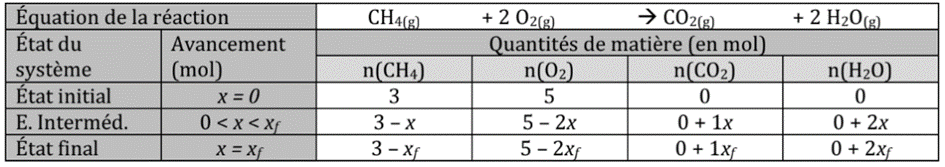
Dans ce cas, le dioxygène (O2) est un réactif limitant et le méthane (CH4) est un réactif en excès. La réaction n’est donc pas totale.
Exemple 2 : pour la réaction entre le méthane (CH4) et le dioxygène (O2)
Avec 3 mol de méthane (CH4) et 6 mol de dioxygène (O2)

Dans ce cas, le mélange initial des réactifs méthane (CH4) et dioxygène (O2) sont dans les « bonnes proportions ». On dit que le mélange initial est stœchiométrique. La réaction est totale. Les quantités finales de réactifs sont nulles.
